Insbesondere patientenberichtete Endpunkte (patient-reported outcomes, kurz: PROs) – also patientenberichtete Symptome und die gesundheitsbezogene Lebensqualität wie auch Endpunkte zu Nebenwirkungen – wurden in den Studien zu Abemaciclib deutlich zu kurz beobachtet, sodass nur Aussagen über einen kleinen Teil der gesamten Beobachtungszeit getroffen werden können. Diese verbreitete Praxis beeinträchtigt nicht nur die frühe Nutzenbewertung, sondern auch die Entscheidungen für oder gegen weitere Behandlungsoptionen für die schwer kranken Betroffenen. Weitere methodische Probleme lassen eine Interpretation der meisten patientenberichteten Endpunkte nicht zu.
Art der Metastasen prägt das Bewertungsergebnis
Der Hersteller hat die Daten seiner Studie MONARCH plus erstmals nach Art der Vorbehandlung getrennt aufbereitet, sodass für die Bewertung nun entsprechende Daten aus zwei Studien (MONARCH 2 und MONARCH plus) zur Verfügung stehen.
Für Frauen, die bis dahin noch keine endokrine Therapie erhalten haben, ist ein Zusatznutzen gegenüber Fulvestrant allein nicht belegt. Wurde bereits eine endokrine Therapie absolviert, gibt es im Fall von viszeralen Metastasen – vor allem aufgrund einer statistisch signifikanten Verlängerung des Gesamtüberlebens – einen Beleg für einen beträchtlichen Zusatznutzen. Betroffene mit nicht viszeralen Metastasen überleben dagegen mit Abemaciclib nicht statistisch signifikant länger als ohne, sodass hier die Nachteile in anderen Endpunkten das Ergebnis prägen: Es verbleibt ein Hinweis auf einen geringeren Nutzen im Vergleich zu einer alleinigen Fulvestrant-Behandlung.
Prägnantes Beispiel für verkürzte Erhebung patientenberichteter Endpunkte
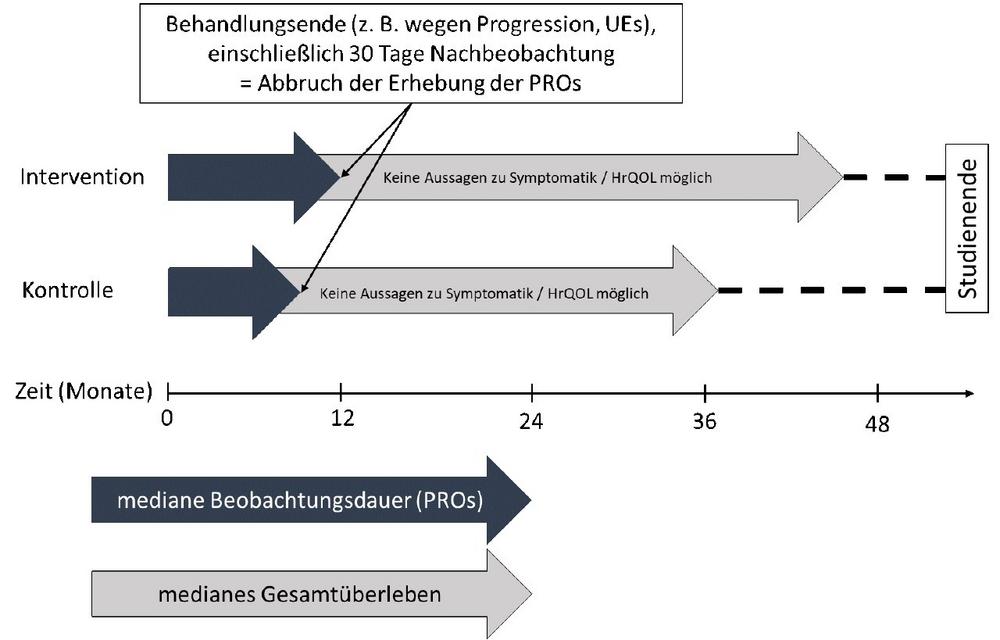
Für die – nach 2019 und 2020 nunmehr dritte – frühe Nutzenbewertung von Abemaciclib in dieser Indikation liegen erstmals Angaben zu den medianen Behandlungs- und Beobachtungsdauern in den relevanten Teilpopulationen der beiden Studien vor. Die Behandlungsdauer ist in beiden Studien im Interventionsarm jeweils deutlich länger als im Kontrollarm. Zudem sind die Beobachtungszeiten für die Endpunkte Morbidität (patientenberichtete Symptomatik), gesundheitsbezogene Lebensqualität und Nebenwirkungen jeweils systematisch und erheblich verkürzt, da sie lediglich während und kurz nach der Behandlung mit der Studienmedikation erhoben wurden. Wie die Abbildung zeigt, decken diese Daten nur etwa ein Viertel der medianen Überlebenszeit ab.
Studienergebnisse müssen interpretierbar sein
Eine solche systematische Verkürzung der Erhebung patientenberichteter Endpunkte auf die Zeit der Behandlung ist in den Studien, die Hersteller in Dossiers für die frühe Nutzenbewertung einreichen, häufig zu verzeichnen – wenn auch nicht immer so gravierend wie in diesem Fall. Sie fällt besonders dann ins Gewicht, wenn Studien nach dem Behandlungsende (bedingt etwa durch eine Progression der Erkrankung oder Abbruch wegen starker Nebenwirkungen) lange weiterlaufen, weil die Teilnehmenden oft noch Jahre leben.
Die verkürzte und zudem in den Studienarmen ungleich lange Datenerhebung schränkt die Interpretierbarkeit der Studienergebnisse stark ein. Beispielsweise ist nicht zu erkennen, ob eine Verschlechterung des Zustands, von der die Betroffenen am Behandlungsende berichtet haben, wirklich von Dauer ist oder sich womöglich kurz danach für den – sehr langen – Rest der Studienlaufzeit wieder gelegt hat. Zudem ist eine anhaltende Verschlechterung während der Behandlung im jeweils länger beobachteten Studienarm (hier dem mit Abemaciclib) möglicherweise allein aufgrund der größeren Zeitstrecke unwahrscheinlicher: eine potenzielle Verzerrung zugunsten des Wirkstoffs.
Abwägen, wie es nach der Behandlung weitergeht
Dabei interessieren sich nicht nur die Mitarbeiterinnen und Mitarbeiter des IQWiG im Zuge ihrer Dossierbewertungen für den weiteren Verlauf der Lebensqualität und der Symptome nach Behandlungsende und Progression, sondern auch die Betroffenen und ihre Ärztinnen und Ärzte. Schließlich müssen sie sich über das Ob und Wie einer anschließenden weiteren Behandlung verständigen, wofür sie beispielsweise einen möglichen Zugewinn an Lebenszeit gegen drohende Beeinträchtigungen der Lebensqualität abwägen möchten. Auch in den beiden MONARCH-Studien hat ein Großteil der Teilnehmerinnen nach dem Behandlungs- und Beobachtungsende mindestens eine weitere systemische Therapie in Anspruch genommen.
Ergebnisse zu Symptomen und Lebensqualität für Betroffene relevant
„Die Studien, die die Hersteller im Zuge des AMNOG vorlegen, sind oft noch stark auf die Zulassung zugeschnitten“, erklärt Thomas Kaiser, Leiter des Ressorts Arzneimittelbewertung im IQWiG. „In solchen Studien werden Daten zu patientenberichteten Endpunkten zu kurz erhoben, z. B. nur bis zur Progression der Erkrankung. Aber natürlich sind für die Betroffenen Symptome und Lebensqualität auch nach einer Verschlechterung der Erkrankung relevant.“
Stark verkürzt erhobene Daten zu patientenberichteten Endpunkten lieferten keine Antworten auf die Frage, ob es den Betroffenen mit einem Arzneimittel auf Dauer besser oder schlechter geht als mit einer anderen Behandlung. Dafür müsse der Zeitverlauf ihres Zustands möglichst lange, also bis zum Studienende, erfasst werden. „Hersteller müssen damit rechnen, dass künstlich verkürzt erhobene Daten die Bewertungsergebnisse künftig nicht mehr maßgeblich beeinflussen können – nicht trotz, sondern gerade wegen der Wichtigkeit patientenberichteter Endpunkte“, wie Thomas Kaiser betont.
G‑BA beschließt über Ausmaß des Zusatznutzens
Die Dossierbewertung ist Teil der frühen Nutzenbewertung gemäß Arzneimittelmarktneuordnungsgesetz (AMNOG), die der G‑BA verantwortet. Nach Publikation der Dossierbewertung führt der G‑BA ein Stellungnahmeverfahren durch und fasst einen abschließenden Beschluss über das Ausmaß des Zusatznutzens.
Einen Überblick über die Ergebnisse der Nutzenbewertung des IQWiG gibt folgende Kurzfassung. Auf der vom IQWiG herausgegebenen Website gesundheitsinformation.de finden Sie zudem allgemein verständliche Informationen.
Das IQWiG ist ein unabhängiges wissenschaftliches Institut, das Nutzen und Schaden medizinischer Maßnahmen für Patienten untersucht. Wir informieren laufend darüber, welche Vor- und Nachteile verschiedene Therapien und Diagnoseverfahren haben können
Stiftung für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
Siegburger Str. 237
50679 Köln
Telefon: +49 (221) 35685-0
Telefax: +49 (221) 35685-1
http://www.iqwig.de
Stabsbereich Kommunikation
E-Mail: jens.flintrop@iqwig.de
![]()